/A totipotens növényi sejtek kontrollált laboratóriumi körülmények között fenntartott in vitro tenyészetei eredetüket és szerveződésük szintjeit tekintve nagyon különbözőek és ennek a változatosságnak megfelelően széles körben sokféle célra felhasználhatók.
A korábbi klasszikusnak nevezhető csoportosítás alapja a tenyészet fejlődéstani állapota. Ha az in vitro rendszer zömmel differenciálatlan sejteket tartalmaz, esetleg egyszerű szövetekből áll sejttenyészetnek tekintjük:
1. A kallusz osztódó parenchimatikus sejtekből álló differenciálatlan sejttenyészet, amely lehet kemény-gömbös, vagy szivacsos-lágy szerkezetű, színe változó. A kallusz (hegszövet) bármilyen élő szövetből előállítható, ha a táptalaj ionkoncentrációja magas, és növényi hormonokat (elsősorban auxinokat) tartalmaz. A 2,4-D /diklór fenoxi ecetsav/ például kifejezetten kalluszosító szintetikus auxin.. A sejtek változatos alakúak, méretűek és genetikailag instabilak, gyakori ebben a rendszerben a mutáció. Az első átoltások során erősen változik a sejtek növekedése, habitusa, anyagcseréje. Csak több átoltás után stabilizálódik a tenyészet.
A növényi szövettenyésztés hőskorában mindenki kalluszt akart létrehozni és hormonvariációkkal hajtás-, gyökér- és teljes növényregenerációt, esetleg szomatikus embriogenezist indukálni a sejtekből. Napjainkban a kallusz a genetikai instabilitás miatt visszaszorul, gyakran nem kívánatos melléktermék, a sejtszuszpenziók létrehozásához azonban ma is nélkülözhetetlen.
2. A sejtszuszpenziók folyékony tápközegben tartott diszpergált sejtek. Általában közvetett módon kalluszból állithatók elő. A sejtek befulladásának elkerülését rázatással, keverőlapátokkal, vagy levegő áramoltatással/un airlift/ biztosítják. A sejtek zöme kisebb nagyobb aggregátumokat képez, csak elvétve találunk a sejtszuszpenziókban magányos sejteket.. A rendszer növekedése gyorsabb, biomassza termelése nagyobb mint a kalluszé, hiszen sejtjeinek jobb a tápanyag ellátása. Annak dacára, hogy ezeket az in vitro rendszereket nehezebb és drágább fenntartani elsősorban a speciális rázógépek, fermentorok és a szabályozó szoftverek ára miatt, a modern növényi biotechnológia néhány területén egyre jobban terjednek. A szuszpenzióban lehet napjainkban a legjobb hatásfokkal indukálni a szomatikus embriogenezist, amikor vegetatív diploid sejtekből hormonális indukció hatására szabályos növényi embriók fejlődnek. Ismerünk technológiákat, melyekkel ezeket az embriókat szinkronizált tenyészetekben millió számra tudják produkálni és normális kifejlődésüket biztosítani, majd megfelelő eljárással kapszulázni, vagy szétvágható szalagra/embrio tape/ csomagolni tápanyaggal és más regulátorokkal együtt. Az így előállított mesterséges mag és üzemi kiültetése az un „folyékony vetés”/ fluid drilling/ ma már nem utópia.
A sejtszuszpenziók kontrollált laboratóriumi körülmények között felhasználhatók arra is, hogy sejtjeik „kis biokémiai üzemek” módjára, értékes vegyületek állítsanak elő. Sőt a sejtszuszpenziós kultúrák új molekulák szintézisére is képesek, melyek az intakt növényekben nem léteznek.. Ez nem meglepő, hiszen in vitro rendszerekben a sejteket erős stresszhatás éri, melyre a sejtek génműködésük /génexpressziójuk/ megváltozásával válaszolnak.
A mikrobiális kultúráktóll eltérően a növényi szuszpenziós tenyészetek sejtjei kezdetben osztódnak, növekednek, a hatóanyag termelés csak a gyarapodási szakasz befejeződésével, később kezdődik. Egy élesztő, vagy antibiotikum termelő mikrogomba sejtjei kezdettől fogva folyamatosan termelik hatóanyagaikat. Ezt ismerve a növényi szuszpenziós tenyészetekben gyakran először egy növekedésre, majd később egy hatóanyag termelésre optimalizált táptalajt alkalmaznak. Ez utóbbi táptalaj a hormonok mellett tartalmazhatja a hatóanyag felépítésében szerepet játszó alapvegyületeket/un „prekuzor” anyagokat/ és speciálisan a hatóanyag termelést serkentő un „elicitor” molekulákat. Mindezekkel a sejt korábbi hatóanyagtermelése akár százszorosára is fokozható.
Általános törekvés, hogy a laboratóriumi kis térfogatú tenyészetekből kilépve félüzemi/un „pilot”-rendszer/, majd üzemi térfogatokban történjen a termelés. A léptéknövelés/ scale up/ azonban nem egy egyszerű edénycsere, számos új technikai és élettani problémával jár. A növényi sejtfermentáció a mikrobiális fermentációhoz hasonlítva még gyermekcipőben tipeg. Nem kell nagy jóstehetség ahhoz, hogy rohamléptű fejlődést jelezzünk előre ezen a területen.
3. A sejtfal mesterséges eltávolításával a növényi sejtek különleges formái izolált protoplasztok nyerhetők, melyeket az állati sejtekhez hasonlóan csupán egy külső sejtmembrán határol. Az ép csupán határmembránnal körülvett izolált protoplasztok ozmotikusan stabilizált közegben az eredeti sejt alakjától függetlenül egységesen gömb alakúak.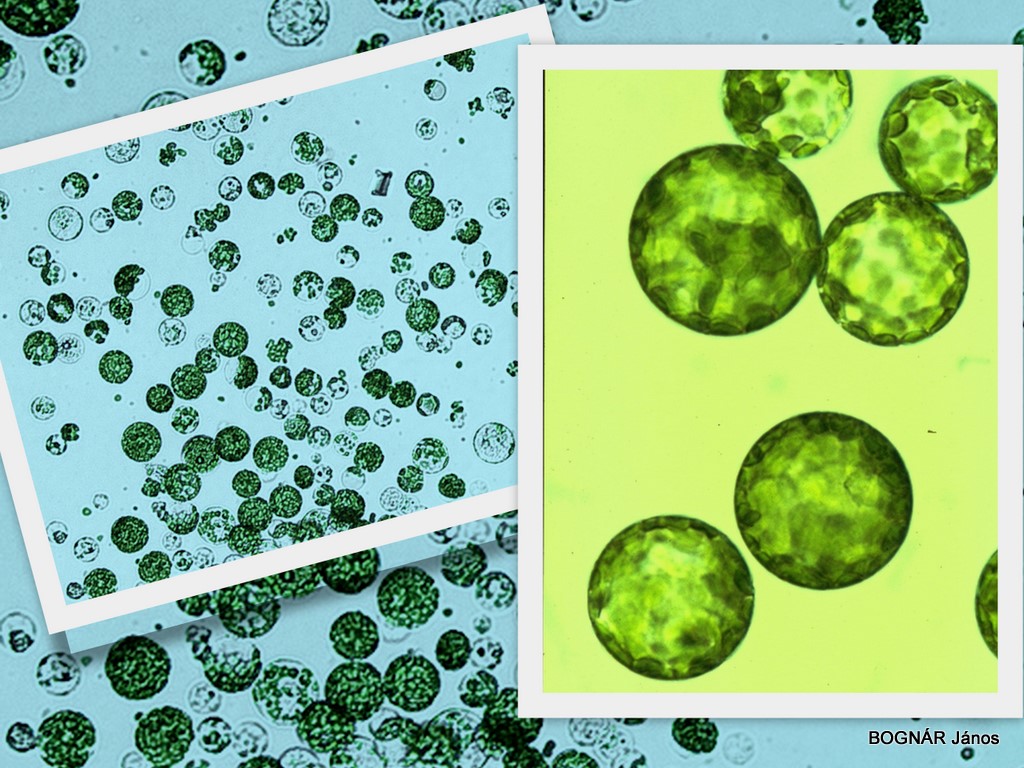
A preparált protoplasztokat sokféle kutatási célra fel lehet használni. Alapkutatások körébe tartozik, de nagyon fontos kérdés a sejt határfelületeinek ismerete a határmembrán/plazmalemma/ szerkezete, összetétele, vagy a sejtfal szintézis kezdeti szakasza. A protoplaszt ezekhez a vizsgálatokhoz ideális objektum.
A növényi biotechnológia izgalmas területe az izolált protoplasztok egyesítése/ fuziója /, a szomatikus sejthibridizáció és ezt követően a hibrid sejtekből újra – most már azonban a szülőktől eltérő genommal rendelkező – növények regenerálása. Jelenleg a protoszplatfúzióra kétféle módszert alkalmaznak: a protoplaszt-szuszpenziókat összekeverik, és ehhez polietilén-glikolt (PEG) adnak, vagy pedig elektromos impulzussal kezelik a sejteket( elektrofúzió un fúziós kamrában).A fúzió maga általában jó hatásfokkal megvalósítható, további komoly gondot jelent azonban a fúziós termékek szétválasztása. Általában a tápközeget használják a szelekcióra, de kapható lézeres sejtválogató berendezés is erre a célra.
Az első protoplasztokat az enzimes eljárással 1960-ban izolálták, nem sokkal ezután már kísérleteztek a protoplasztok fúziójával is. Először sikeresen egy adott faj protoplasztjainak fúziójával dupla vagy magasabb kromoszómaszámú poliploid un homokarion sejthibrideket és növényeket állítottak elő. 1971-ben sikerült először két dohányfaj protoplasztjainak fuziójából szomatikus dohány fajhibrid növényt létrehozni.Ez már heterokarion sejthibrid, hiszen két faj protoplaszt fúziójából jött létre.. 1978-ban a burgonya és paradicsom protoplasztok fuziójával keletkezett sejthibridekből először Németországban neveltek fel intergenerikus nemzetséghibrid növényeket. Magyar kutatók 1987-ben állították elő a dohány-sárgarépa sejthibridbekből a NICA nevű intergenerikus hibrid növényt.
Napjainkban számos mutáns hibridnövényt ismer a tudomány és a gyakorlat, melyek létrehozásában a protoplaszt fúziós, vagy az irányított génbevitel technika szerepet játszott. A protoplaszt fúzió nem egy célzott, irányított beavatkozás. Pontosan előre nem lehet jelezni az eredményt. Nem lehet tudni, hogy milyen tulajdonságok stabilizálódnak végül, és bizony a kiszámíthatatlanság miatt hátrányos tulajdonságok is megjelenhetnek. A már említett burgonya-paradicsom hibridek egy része inkább a paradicsomra hasonlít( angol nevüket magyarra fordítva:burdicsom), míg a másik részénél inkább a burgonya jellegek a meghatározók( az előbbiek alapján ez a pargonya). Számos további kísérlet igazolta, hogy a szomaklonális variabilitás állandó eleme ezeknek a kísérleteknek.
Az irányított génbevitelnél a várható eredmény jobban előre jelezhető. Idegen DNS szakaszok, vagy akár teljes kromoszómák bejuttatására és ezen az úton un transzgénikus(TM) növények létrehozására könnyebben adott a lehetőség a sejtfal mentes protoplaszt állapotban. Ilyenkor közvetítőként általában az Agrobacterium mikroorganizmusok néhány faját használják a biotechnológiában.
Ma inkább ezen a területen látunk rohamos fejlődést, különösen az ellenálló, rezisztens fajták létrehozásánál. A ma használt génmódosított(GMO) növények zöme irányított génbevitellel létrehozott valamilyen tényezőre rezisztens fajta. A dohány protoplaszt genomba beépített szentjánosbogár luciferáz gén és az így létrehozott megfelelő körülmények között világító levelű dohány inkább a technika távlatait mutató modell értékű szenzáció. Az izolált protoplasztok felhasználásának is meg vannak a határai, azonban a modern növényi biotechnológia kelléktárában egyszerűen nélkülözhetetlenek.


A folyékony vetés (egyben genetikailag azonos növény)
lehetósége fantasztikus előrelépés, de mi a váleményed a GMO-hibridek termesztésének várható eredményeiről és/vagy veszélyeiről! (Rémálom, vagy Realitás!)